Химический состав антифриза g11, g12, g13
Антифриз — низкозамерзающая жидкость для охлаждения, очистки и смазки конструкционных элементов двигателя, тепловых установок, работающих при отрицательных температурах. Охлаждающие концентраты обладают низким коэффициентом расширения и снижают точку замерзания воды. Как итог: в момент кристаллизации лёд в трубопроводных каналах практически не расширяется и сохраняется целостность конструкции. Рассмотрим подробный химический состав антифриза.Компонентный состав
Основу охлаждающих жидкостей (ОЖ) составляет дистиллированная вода в смеси с одно- и многоатомными спиртами в различных пропорциях. Также в концентрах вводят ингибиторы коррозии, а также флуоресцентные добавки (красители). В качестве спиртовой основы используется этиленгликоль, пропиленгликоль или глицерин (до 20%).
- Водный дистиллят
Используется очищенная, умягчённая вода. В противном случае на радиаторной решётке и стенках трубопровода образуется накипь в виде карбонатных и фосфатных осадков.
Двухатомный насыщенный спирт без цвета и запаха. Токсичная маслянистая жидкость с температурой замерзания -12 °С. Обладает смазывающими свойствами. Для получения готового антифриза используют смесь из 75% этиленгликоля и 25% воды. Содержание присадок игнорируется (менее 1%).
Он же пропиленгликоль — ближайший гомолог этандиола с тремя атомами углерода в цепи. Нетоксичная жидкость со слабым сладковато-горьким вкусом. Товарный антифриз может содержать 25%, 50% или 75% пропиленгликоля. В силу дороговизны, используется реже по сравнению с этандиолом.
Виды присадок
Этиленгликолевый антифриз для авто в процессе длительной эксплуатации окисляется и образует гликолевую, реже муравьиную кислоту. Таким образом, создаётся неблагоприятная для металла кислотная среда. Чтобы исключить окислительные процессы в охлаждающую жидкость вводят антикоррозионные присадки.
- Неорганические ингибиторы коррозии
Или «традиционные» — смеси на основе силикатов, нитратных, нитритных или фосфатных солей. Подобные присадки выполняют роль щелочного буфера и образуют на поверхности металла инертную плёнку, которая препятствует воздействию спирта и его продуктов окисления. Антифризы с неорганическими ингибиторами маркируются обозначением «G11» и имеют зелёную либо синюю окраску. Неорганические ингибиторы включены в состав тосола — охлаждающей жидкости отечественного производства. Срок службы органичен 2-мя годами.
Подобные присадки выполняют роль щелочного буфера и образуют на поверхности металла инертную плёнку, которая препятствует воздействию спирта и его продуктов окисления. Антифризы с неорганическими ингибиторами маркируются обозначением «G11» и имеют зелёную либо синюю окраску. Неорганические ингибиторы включены в состав тосола — охлаждающей жидкости отечественного производства. Срок службы органичен 2-мя годами.
- Органические ингибиторы
В силу ограниченного ресурса неорганических ингибиторов были разработаны более экологичные и химически стойкие аналоги — карбоксилаты. Соли карбоновых кислот экранируют не всю рабочую поверхность, а исключительно очаг коррозии, покрывая область тонкой плёнкой. Обозначаются как «G12». Срок службы — до 5-и лет. Имеют красную или розовую окраску.
В отдельных случаях «органику» смешивают с «неорганикой» с получением гибридных антифризов. Жидкость представляет смесь карбоксилатов и неорганических солей. Длительность использование составляет не более 3-х лет. Цвет — зелёный.
Длительность использование составляет не более 3-х лет. Цвет — зелёный.
Состав концентрата в подобном случае включает минеральные реагенты и органические антикоррозионные присадки. Первые образуют наноплёнку по всей поверхности металла, вторые — защищают повреждённые участки. Срок использования достигает 20 лет.
Заключение
Охлаждающая жидкость снижает температуру замерзания воды и уменьшает коэффициент расширения. Химический состав антифриза представляет смесь дистиллированной воды со спиртами, а также включает ингибиторы коррозии и красители.
стандартная рецептура антифриза по ГОСТу, характеристика и свойства марки а-40
Охлаждающая жидкость, которая используется для системы охлаждения в двигателе автомобиля, называется антифриз или тосол. В самых первых охлаждающих жидкостях для автомобилей отсутствовали антикоррозийные присадки, в результате чего некоторые детали системы охлаждения покрывались ржавчиной и выходили из строя. Со временем состав жидкости значительно улучшился и даже разделился на две категории — летний и зимний тосол.
В самых первых охлаждающих жидкостях для автомобилей отсутствовали антикоррозийные присадки, в результате чего некоторые детали системы охлаждения покрывались ржавчиной и выходили из строя. Со временем состав жидкости значительно улучшился и даже разделился на две категории — летний и зимний тосол.
Химический состав охлаждающей жидкости
Сегодня каждая марка тосола, которая продаётся на широком рынке, отличается только количеством воды и различных присадок в составе жидкости. Основа же любого тосола — этиленгликоль. Это спирт, который имеет в своей структуре два атома. Эта вязкая, бесцветная жидкость со сладковатым привкусом. Использовать его можно практически при любых суровых погодных условиях, так как этиленгликоль не замерзает даже при температуре -198 градусов.
Этот спирт обладает такими свойствами, при которых вода не будет замерзать в промежутке градусов от -1 и до -89 градусов. И если оптимально соединить водный раствор и спирт, то получится жидкость, которая не будет замерзать и выдержит температуру до 78 градусов по Цельсию.
В химический состав тосола включают такие компоненты:
- глицерин;
- фосфаты;
- присадки, обладающие антикоррозийным действием;
- гликоль;
- бураты.
Все эти компоненты отвечают за качество охлаждающей жидкости. Требованиями для нормальной работы автотранспорта должны соответствовать следующие свойства тосола:
- Не замерзать при низких температурах. Эксплуатация автомобиля при аномально низких градусах по Цельсию должна быть комфортной и неопасной для транспорта.
- Теми же качествами должна обладать жидкость и при высоких температурах. Это касается работы двигателя в жаркий, летний период.
- Хорошая циркуляция тосола в системе должна быть обусловлена приемлемой вязкостью охлаждающей жидкости.
Именно такими свойствами и обладает качественная незамерзающая жидкость для системы охлаждения. ГОСТ на эту жидкость был введён ещё в 1989 году, и с тех пор все отечественные производители выпускают тосол по этим стандартам.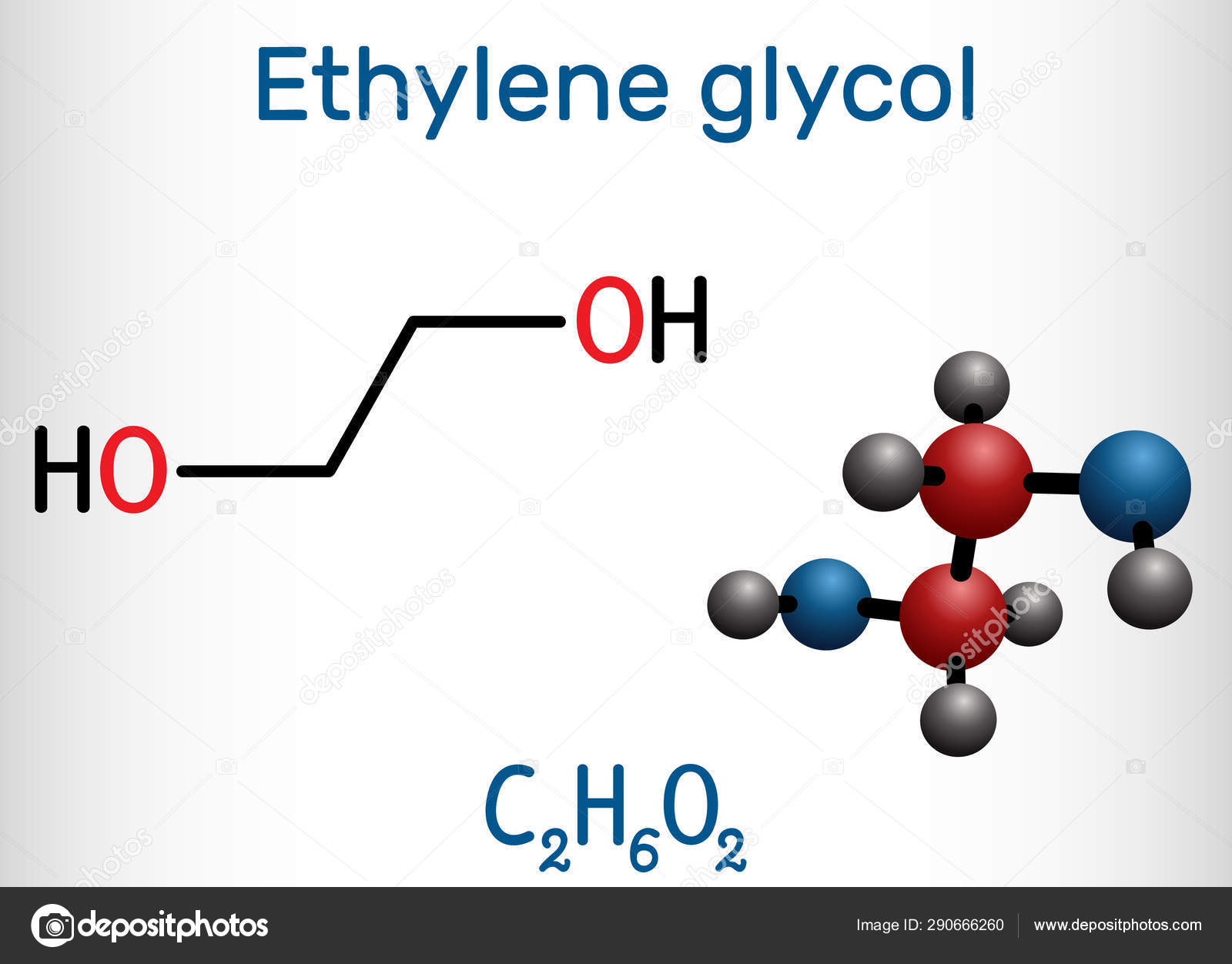 Производимые антифризы по ТУ имеют несколько другой состав тосола, ГОСТ на них не распространяется.
Производимые антифризы по ТУ имеют несколько другой состав тосола, ГОСТ на них не распространяется.
Важно знать, что со временем химический состав тосола несколько изменяется под воздействием внешних факторов. Поэтому для нормальной работы всех систем необходимо производить замену незамерзайки после каждых 25 тысяч километров.
Характеристика тосола а-40м
Первый советский антифриз был разработан в 1971 году. Предназначался он для использования в автомашинах ВАЗ. Затем его стали применять и для другого транспорта. Буквенное выражение в виде «А» означает, что раствор предназначен только для автотранспорта. А буква M говорит о том, что тосол модернизированный.
Состав тосола а 40 является высшего качества. Основная составляющая этого раствора — спирт этиленгликоль. А также в его состав входят различные антикоррозийные и антипенные присадки.
Основные характеристики антифриза а-40 это:
- Выдерживает температуру и не замерзает при -45 градусах.

- Температура закипания по Цельсию 110 градусов.
- Отсутствует вспениваемость.
- Не влияет своим химическим составом на другие системы автомобиля.
- Обладает пониженной плотностью.
- При хранении не портится и не разлагается.
Основные виды хладагента
Ещё одно нарицательное название тосола — хладагент, или как его называют в народе — незамерзайка. Существует два вида антифриза, они различаются по цветам. Зелёный цвет имеет охлаждающая жидкость силикатная, красный цвет у хладагента карбоксильного.
Оба этих вида антифриза покрывают отдельные части системы небольшой накипью и препятствуют коррозии метала. Красный антифриз имеет более длительный срок службы, и после его замены не требуется промывка всей системы охлаждения.
Чтобы различить антифризы, существует специальная маркировка. Так, антифриз силикатный на упаковке имеет обозначение G11. Рецептура такой жидкости содержит в себе такие компоненты, как амины, нитриты, нитраты, бораты, силикаты, фосфаты.
Карбоксильный антифриз обозначается G12. В европейских странах его используют на автотранспорте, выпущенном до 2001 г. В основном своём виде он красного или розового цвета.
Как выявить некачественный антифриз
Если в небольшую ёмкость отлить немного незамерзайки и к ней добавить щепотку пищевой соды, можно посмотреть на реакцию раствора. Если ничего не произошло, можно спокойно использовать антифриз по назначению.
Можно проверить тосол, его свойства и состав ареометром и лакмусовой бумажкой. Ареометром проверяется плотность тосола. Лакмусовой бумажкой определяется кислотность антифриза. В идеале бумажка должна быть зелёного цвета.
Если же она изменила свой цвет и стала красной или розовой, это означает, что в жидкости присутствует очень много кислоты, а она может повредить некоторые детали системы.
Зная эти основные и нехитрые способы проверки, можно обезопасить свой автомобиль от нежелательных последствий.
Автохимический ликбез. Из чего состоит антифриз?
Как известно, антифризы состоят из смеси воды, присадок и спирта – метанола, этиленгликоля, пропиленгликоля, глицерина.
Вспомнить курс школьной химии поможет данная статья.
Метанол
Метанол, также известный как древесный спирт или метиловый спирт – химическое соединение с формулой СН3ОН. Самый простой из спиртов. Легкий, летучий, жидкий, с характерным запахом. Используется в качестве антифриза, растворителя, денатуратора для этилового спирта, в жидкостях для омывателя лобового стекла.
Не используется с 20-х годов 20 века из-за ряда недостатков:
— Токсичен для человека. Накапливается в организме. Летальный исход наступает при принятии внутрь 80 мл. В воздухе предельная допустимая концентрация – 5мг/м3
Накапливается в организме. Летальный исход наступает при принятии внутрь 80 мл. В воздухе предельная допустимая концентрация – 5мг/м3
— Вступает в реакцию с алюминием, вызывает быструю коррозию деталей двигателя. Двигатель быстрее ломается.
— В открытых системах охлаждения быстро испаряется, отравляя воздух. Нужно заливать повторно. Если вовремя не пополнить, двигатель перегревался, а вода замерзала и снова ломала двигатель. Нужно было держать постоянную пропорцию.
Токсичен!!!
Опасный яд. При попадании в организм 10 мл метилового спирта вызывает тяжелое отравление, слепоту, озноб, рвоту.
Tемпература плавления — минус 97 градусов С, Температура кипения – минус 64 градусов С, Теплопроводность – 0,21 при 0 градусах С; 0,182 при 100С Вт/(м*К), Плотность – 0,8 г/м3.
Глицерин
От греческого γλυκός — сладкий. Вязкая, прозрачная жидкость. Не имеет цвета, легко смешивается с водой. Обладает сладким вкусом. В соединении с пропиленгликолем становится более вязким при понижении температуры. Химическая формула — C3H8O3.
Обладает сладким вкусом. В соединении с пропиленгликолем становится более вязким при понижении температуры. Химическая формула — C3H8O3.
Глицерин исторически использовался в качестве антифриза для автомобильных применений, прежде чем был заменен этиленгликолем, который имеет более низкую температуру замерзания. Хотя минимальная температура замерзания смеси глицерина и воды выше, чем смесь этиленгликоля и воды, глицерин не токсичен и в настоящее время пересматривается для использования в автомобильной промышленности.
Tемпература плавления — -18 град.С., Температура кипения – 290 град.С., Теплопроводность – 0,21 при 0 град.С; 0,182 при 100С Вт/(м*К)., Плотность – 0, 8 г/м3.
Этиленгликоль.
Двухатомный спирт с химической формулой C2H6O2. Прозрачная жидкость без цвета, запаха. Имеет сладковатый вкус, из-за чего его иногда пьют животные и дети. Используется в антифризах с 1926 года
В системе охлаждения может окисляться до 5 органических кислот – муравьиной, щавелевой, гликолевой, глиоксалевой, уксусной. Поэтому используют присадки – азолы, нитриты, силикаты, бораты, чтобы этиленкгликоль не окислялся, и сохранялся pH раствора.
Поэтому используют присадки – азолы, нитриты, силикаты, бораты, чтобы этиленкгликоль не окислялся, и сохранялся pH раствора.
Средне токсичен. Требуется утилизация и аккуратное обращение при транспортировке. Из-за сладкого вкуса дети и животные могут проглатывать его. Сложно обнаружить в огранизме. Симптомы отравления – интоксикация, диарея, рвота. При попадании в организм поражает мозг, сердце, легкие и почки. При острой почечной недостаточности смерть наступает в течение 72 часов, если пострадавший не получит надлежащего лечения. Некоторые антифризные смеси этиленгликоля содержат озлобляющий агент горького вкуса, такой как денатоний, для предотвращения случайного или преднамеренного потребления.
Австралия, Великобритания и семнадцать штатов США (по состоянию на 2012 год) требуют добавления горького ароматизатора (бензоат денатония) в антифриз на основе этиленгликоля.
Tемпература плавления — минус 13 град.С., Температура кипения – 193 градусов С. Теплопроводность – 0,242 при 0С; 0,263 при 100С Вт/(м*К). Плотность – 1, 113 г/м3.
Теплопроводность – 0,242 при 0С; 0,263 при 100С Вт/(м*К). Плотность – 1, 113 г/м3.
Пропиленгликоль.
Пропиленгликоль – прозрачная жидкость с химической формулой Сh3(OH)-СH(OH)-Сh4 Вязкая жидкость, имеет характерный запах и сладкий вкус. Используется как растворитель для одноатомных спиртов, аминов, сложных эфиров, альдегидов, различных кислот.
Коррозионная активность пропиленгликоля ниже, чем у большинства известных водных растворов солей и спиртов, что позволяет предъявлять невысокие требования к сортности стали для оборудования и снизить стоимость используемого оборудования
Нетоксичен.
В пище используется как добавка E1520. Не рекомендуется попадание пропиленгликоля на поврежденную кожу с дерматитом, экземами, аллергиков. При соприкосновении с воздухом окисляется и образует молочную кислоту. В антифриза с пропиленгликолем добавляют присадки, которые стабилизируют pH. Помимо коррозии вызывает биологическое загрязнения. Биологичесакий осадок в виде бактериальной слизи. Которая растет и ускоряет коррозию элементов системы охлаждения. В отсутствие ингибиторов пропиленгликоль может реагировать с кислородом и ионами металлов, создавая различные соединения, включая органические кислоты (например, муравьиную, щавелевую, уксусную). Эти кислоты ускоряют коррозию металлов в системе.
Tемпература плавления — минус 60 град С., Температура кипения – 187 град.С., Теплопроводность – 0,218 Вт/(м*К), Плотность – 1, 036 г/м3.
Также в антифризах присутствуют красители. Для чего они нужны?
Динатриевые флуоресцеиновые красители добавляются к антифризу для отслеживания источника утечек и в качестве идентификатора, поскольку некоторые другие формулировки несовместимы. Краситель добавляется для индикации уровня жидкости в расширительном бачке и мест протечек, а также просто как отличительный признак антифриза на рынке.
В традиционных антифризах этиленгликоль, пропиленгликоль, глицерин: понижают температуру замерзания, повышают температуру кипения.
Но зачем тогда присадки?
Ответ:
• Борат – защищают от коррозии, повышают уровень pH.
• Нитрат – защищают от коррозии алюминий.
• Нитрит – защищают от коррозии чугун и сталь.
• Фосфат – защищают от коррозии, контролируют уровень pH.
• Силикаты – защищают от коррозии алюминий.
• Азолы – защищают от коррозии медь и латунь.
• Кремниевые и блочные полимеры – гасят пену.
Присадки составляют от 3% до 5% антифриза. Определяют стоимость и дополнительные свойства антифриза. Используются для защиты от коррозии, контроля уровня pH и для предотвращения появления пены. На упаковке указывается лишь существенные факторы безопасности при использовании, присадки же хрянятся в секрете. Каждый производитель разрабатывает в секрете. Раствор этиленгкликоля и воды агрессивен к металлам, поэтому добавляют антикоррозийные присадки.
3 основных механизма защиты металла:
• Пассавация металла или армирование пассивного слоя оксида металла. При пассавации поверхностный слой металла переходит в пассивное состояние. На поверхности образуется тонкая оксидная пленка, которая не взаимодействует с водой и не коррозирует.
• Образуется толстый барьерный слой из ингибитора коррозии или продуктов реакции ингибитора и металла.
• Образуется тонкий барьерный слой на поверхности металла через варьирование степени хемосорбции, то есть способности поглощать твердым телом вещества из растворов.
Коррозийные ингибиторы.
В состав большинства антифризов входят коррозийные ингибиторы. Ингибиторы – класс веществ, которые предотвращают или замедляют физиологические или физико-химических процессов. В замкнутой системе этиленгликоль и пропиленгликоль сохраняют свои свойства неограниченно долго. В отличие от этого ингибиторы коррозии постепенно истощаются, их необходимо время от времени пополнять.
Традиционные ингибиторы.
Традиционные ингибиторы – силикаты, фосфаты и нитриты. В Америке используется и то, и то. В Европе силикаты, другие ингибиторы, но нет фосфатов, потому что вода более жесткая в Европе, а фосфаты вступают в реакцию с жесткой воды образуют накипь, отложения солей кальция и магния. . Японцы используют фосфаты и другие, но не силикаты. В Росии используют силикаты и нитриты.
Карбоксилатные ингибиторы.
Состоят из солей карбиновых кислот. Антифризы с карбиновыми ингибиторами расходуются медленней. Карбоксилатные ингибиторы образуют очень тонкий защитный слой только в мечтах появлении коррозии. Не агрессивны к металлам.
Автовладельцы покупают некачественные жидкости для системы охлаждения не из жадности и не по глупости. На прилавке все антифризы выглядят вполне пристойно, да а ценники у них схожие. Разница в цене зависит обычно от аппетита продавца и его маркетинговых уловок (привлекательная реклама, красивая упаковка, рекламные акции), но часто не от содержимого. Чтобы помочь автолюбителям выбрать хорошую жидкость, можно провести очень лёгкий тест.
Как проверить качество антифриза?
Легко! Огнём!
Этот тест настолько прост, что повторить опыт сможет любой желающий. В том числе и производители, у которых возникнут сомнения в результате этого метода: нужно просто проверить, горит продукция или нет.
Охлаждающая жидкость становится легковоспламеняемой, когда вместо дорогостоящего этиленгликоля производитель использует более дешевые глицерин и метанол. Ведь температура кипения метанола — всего лишь 64 градуса с хвостиком (нормальная охлаждающая жидкость закипает при температуре примерно 108 ºС). И это опасно уже только потому, что такой антифриз может вспыхнуть, случайно угодив, к примеру, на раскаленный коллектор.
Простой подбор автозапчастей
Заказать оригинальные запчасти для иномарок в Auto3N можно в два клика. Подберите в быстром и удобном поиске нужные детали, а мы доставим их в любую точку России.
Перейти в каталогИстория появления антифризов.
Первый двигатель внутреннего сгорания и охлаждающие жидкости.
В 1860 году французский инженер Жан Этьен Ленуар сконструировал двухтактный двигатель внутреннего сгорания. Поршни охлаждались воздухом. Позже он ввел открытую систему водного охлаждения. Где вода испарялась и снижала температуру оставшейся воды. Вода не очищалась, а заливалась из природных источников. При испарении оставляла соли, накипь и осадок. Если температура опускалась ниже нуля, вода замерзала, расширялась и изнутри разрушала двигатель. Соли, которые содержатся в воде, приводили к коррозии и образованию биологического налета.
Вода способна поглощать больше тепла на литр, чем любой другой жидкий хладагент. В стандартных условиях вода:
— Закимпает при 100град.С на уровне моря.
— Замерзает при 0град. С на уровне моря
— Когда вода замерзает, молекулы воды упорядочиваются и образуют кристаллическую решетку.
При этом вода увеличивает объем на 9%. Увеличение воды легко ломает блоки двигателя, головки цилиндров и радиаторы. Поэтому в ранние годы автомобилестроения зимой или в холодные ночи воду сливали из системы охлаждения.
Первый радиатор для водного охлаждения установил Карл Бенц, а в 1900 году Вильгельм Майбах разработал первый сотовый радиатор для Mercedes 35hp.
Mercedes 35hp
1900-е годы
В начале 20 века самым популярным незамерзающим решением охлаждающей жидкости был раствор воды и соли или хлорида кальция. На литр воды добавляли 0,5 кг соли. Такой раствор не замерзал до -17С. Другие растворы включали глицерин – густую, прозрачную жидкость, сладкую на вкус, полученную из животных жиров и метанол – древесный или метиловый спирт, промышленный химикат, который используется как растворитель. У метанола температура замерзания — минус 97,6С .
Метанол имел ряд недостатков:
1. Токсичен для человека. Накапливается в организме. Летальный исход наступает при принятии внутрь 30 мл метанола. В воздухе предельная допустимая концентрация – 5мг/м3.
2. Вступал в реакцию с алюминием, вызывал быструю коррозию деталей двигателя. Двигатель быстрее ломался.
3. В открытых системах охлаждения быстро испарялся, отравлял воздух. Уровень охлаждающей жидкости нужно было постоянно пополнять. Если вовремя не залить метанол, двигатель перегревался, а вода замерзала и снова ломала двигатель.
Спирт меняли 3-4 раза за сезон, глицерин использовали несколько раз, сливали зимой и заливали снова следующем сезоне.
В 1910 стали применять глицерин, свободный от электролитов. Такой глицерин не оказывал коррозийного воздействия на металлы и не повреждал резину. Очень медленно испарялся и использовался 2-3 года. Можно было слить в конце холодного сезона и снова использовать в следующем.
1925. Антифриз на основе этиленгликоля.
В 1925 году ряд производителей – McKay, Johnson’s, стал выпускать антифриз на основе этиленгликоля.
Впервые этиленгликоль получил французский химик Чарльз Адольф Вюрц в 1859 году как результат реакции этилендиацетата и гидроксида калия. В начале 20-го века обнаружили, что вещество работает как охлаждающая жидкость, а также пригоден для замены глицирина во взрывчатках. Во время первой мировой войны (1914-1918) соединение синтезировали из этиленхлорида. Низкая температура замерзания и высокая температура кипения сделали его идеальным для использования в двигателе автомобилей.
В 1925 году в США компания Кабрид и Карбон Кемикалс1 запустила масштабное производство этиленгликоля. В 1926 этиленгликоль начали использовать как автомобильный антифриз. После войны этиленгликоль стал доминирующим химическим антифризом до конца 20 века. Другие химические вещества, такие как пропиленгликоль и технология органических кислот (OAT), начали набирать популярность, но этиленгликоль по-прежнему широко используется. Продавался по такой же цене, что и глицерин. 1 — Carbide and Carbon Chemicals Company. Сегодня компания называется Union Carbide Corporation. Из стандарта международного сообщества инженеров — SAE (Society of Automotive Engineers)от 01.01.1926 года. Глицерин дает большую защиту от замерзания, чем глицерин или денатурированные спиртовые растворы того же объема-процента, практически нелетучий, не более коррозионный, чем вода, и лишь слегка более вязкий при низких температурах, чем растворы денатурированного спирта той же концентрации.
К 1940 году антифризы на основе этиленгликоля превосходят по популярности глицериновые и метаноловые. Смесь этиленгликоля с водой очень корозионноактивная, более агрессивная к металлам, чем просто вода. Поэтому в это же время стали добавлять первые антикоррозийные и антипенные присадки, которые защищали металлические поверхности от образования коррозии и снижали возможность образования пены в системе охлаждения.
Антифриз — это… Что такое Антифриз?
Антифриз (от греч. ἀντι- — против и англ. freeze — замерзать) — общее название для жидкостей, не замерзающих при низких температурах. Применяются в установках, работающих при низких температурах, для охлаждения двигателей внутреннего сгорания, в качестве авиационных противообледенительных жидкостей. В качестве базовых жидкостей антифризов используются смеси этиленгликоля, пропиленгликоля, глицерина, одноатомных спиртов и других веществ с водой.
Автомобильные антифризы
Антифризом чаще всего называют автомобильную охлаждающую жидкость, так как температура её замерзания ниже температуры замерзания воды. Антифриз предназначен для предотвращения повреждения деталей, вызванного расширением воды при её замерзании. Антифризы не только имеют более низкую температуру замерзания (точнее — точку начала выпадения кристаллической фазы), но и при замерзании образуют кашеобразную массу, образование которой не повреждает детали двигателя, хотя и не позволяет двигателю нормально работать. Поэтому температура замерзания является важной эксплуатационной характеристикой антифриза.
Автомобильные антифризы состоят из этиленгликоля, воды и пакета присадок, придающих антифризу антикоррозионные — ингибиторы коррозии, антикавитационные, антипенные и флуоресцентные свойства. Этиленгликоль, помимо понижения температуры замерзания, приводит к повышению температуры кипения охлаждающей жидкости, что является дополнительным преимуществом при эксплуатации автомобилей в теплое время года. В антифризы добавляют красители, придающие антифризу тот или иной цвет, не имеющий отношения к его эксплуатационным свойствам и являющийся предметом договоренности производителя и потребителя. Часто один и тот же антифриз окрашивают в разные цвета для разных потребителей. Во многих случаях цвет антифриза может изменяться при эксплуатации в зависимости от сохранности пакета присадок, в этих случаях изменение цвета сигнализирует о непригодности антифриза для дальнейшего использования.
В настоящее время антифризы по составу антикоррозионных присадок делятся на 4 типа карбоксилатный (ОАТ), гибридный (Hybrid), лобрид (Lobrid) и традиционный (Traditional).
Карбоксилатные антифризы
Карбоксилатные антифризы содержат ингибиторы коррозии на основе органических (карбоновых) кислот. В иностранной литературе обозначаются как «Carboxilate coolants», OAT (Organic Acid Technology). Карбоксилатные ингибиторы не образуют защитного слоя по всей поверхности системы, адсорбируются лишь в местах (очагах) возникновения коррозии с образованием защитных слоев толщиной не более 0,1 микрона. Карбоксилатный антифриз имеет больший срок службы (более 5 лет, против 3-5 лет у гибридного и 2 лет у традиционного) и лучше защищает металлы от коррозии и кавитации, что обеспечивает оптимальное охлаждение двигателя.
Гибридные антифризы
Гибридные антифризы содержат, кроме органических (карбоксилатных)ингибиторов, также и неорганические ингибиторы — силикаты (европейская технология), нитриты (американская технология) или фосфаты (японская и корейская технология). Обозначаются термином «hybrid coolants», HOAT (Hybrid Organic Acid Technology).
Антифризы лобрид
Начиная с 2008 г. появился новый вид антифризов, в которых органическая основа сочетается с небольшим количеством минеральных ингибиторов. Для них еще не установлено общепринятого обозначения. Разработчики называют их «Lobrid coolants» или «SOAT coolants».[1]
Традиционные антифризы
Традиционные антифризы в качестве ингибиторов коррозии содержит неорганические вещества — силикаты, фосфаты, бораты, нитриты, амины, нитраты и их комбинации. Обозначаются терминами «Traditional coolants», «Conventional coolants», IAT (Inorganic Acid Technology).
Традиционные антифризы считаются морально устаревшими, их не применяют на первой заправке автомобилей, они в основном вышли из употребления. Это связано с тем, что неорганические ингибиторы имеют небольшой (не более 2 лет) срок службы, и не выдерживают высоких (более 105 °C) температур. Силикаты в процессе эксплуатации покрывает всю внутреннюю поверхность системы охлаждения силикатным слоем, что ухудшает теплообмен и снижает эффективность охлаждения двигателя. Тосол и его многочисленные модификации относятся к традиционному типу антифризов.
На практике часто используется символика компании Volkswagen для обозначения карбоксилатных антифризов G-12 и G-12+, для обозначения гибридных антифризов G-11, для обозначения «Lobrid coolants» G-12++.
Смешивать можно антифризы одного типа. Смешение антифризов разных типов не рекомендуется, так как это разбалансирует пакеты присадок.
См. также
Примечания
- ↑ Ошибка в сносках?: Неверный тег
<ref>; для сносокartecoне указан текст
Основные национальные стандарты на охлаждающие жидкости
- ГОСТ 28084-89 (Российская Федерация)
- BS 6580: 1992 (Великобритания)
- SAE J 1034 (США)
- ASTM D 3306 (США)
- ONORM V5123 (Австрия)
- AFNOR NF R15-601 (Франция)
- CUNA NC956 16 (Италия)
- JIS K2234 (Япония)
- G-11 (Швеция)
Ссылки
История создания антифриза и ТОСОЛа
Первые антифризы появились в 1920-е годы ХХ века. Изготавливались они на основе глицерина (температура кипения 290?С), а потому кроме низкой температуры замерзания обладали также высокой вязкостью и отвратительной текучестью. Гонять такой «кисель» по каналам системы охлаждения и трубкам радиатора — для водяного насоса задача не из простых. С техническими проблемами справились, когда к глицерину начали добавлять этанол. Текучесть заметно улучшилась, но взамен получили «человеческий фактор». Этанол — сильный психотропный яд, что-то вроде наркотика. И водители, невольно нанюхавшись, вытворяли затем за рулем такое, что в здравом рассудке объяснению не поддавалось.
Замена этанолу, а заодно и глицерину нашлась в виде этиленгликоля 1. Правда, это тоже отрава, но не психотропная, а вызывающая поражение почек. Кое-кто попробовал, и это стало уроком для остальных.
Сам по себе в чистом виде этиленгликоль замерзает уже при 12 градусах мороза. Но прибавьте к этиленгликолю всего два процента воды, и эта смесь, которую-то и раствором язык не поворачивается назвать ввиду ничтожного количества воды, начнет кристаллизоваться уже при минус 20 градусах. Еще прибавляем воду, и температура застывания смеси опять понижается. И так будет продолжаться, пока содержание воды в растворе не достигнет 65-70%. Теперь температура, при которой замерзнет «вода плюс этиленгликоль», будет достигать минус 70?С. Причем сам раствор при замерзании превращается в кашеобразную массу, нисколько не увеличивает свой объем, как это случается со льдом, и, следовательно, не «размораживает» двигатель и радиатор. Но дальнейшее увеличение концентрации воды в антифризе чревато серьезными последствиями, поскольку начинается обратный процесс — температура замерзания растет. Когда вода занимает уже 3/4 объема раствора, антифриз застынет всего лишь при 10 градусах мороза.
Смесь этиленгликоля с водой отличает высокая коррозийная активность к цветным металлам и склонность к вспениванию. Поэтому в раствор вводят в небольших количествах специальные присадки, призванные подавлять отрицательные свойства антифриза. Охлаждающую жидкость с набором присадок и содержанием этиленгликоля 40% знает каждый автолюбитель. Это «Тосол А40».
Ассортимент охлаждающих жидкостей, выпускаемых в СССР, разнообразием не отличался. Не отличался настолько, что «Тосол», как основной антифриз тех времен, превратился в имя нарицательное, и нынче автолюбители называют тосолами любые охлаждающие жидкости, в том числе и импортные. А на самом деле «ТОСОЛ» — всего лишь аббревиатура. Т.О.С. — Технологии Органического Синтеза. Это первые буквы названия отдела в Государственном научно-исследовательском институте органической химии и технологии (ГосНИИОХТ), который в 1971 году разработал охлаждающую жидкость для автомобилей ВАЗ взамен итальянского “ПАРАФЛЮ”. ОЛ — окончание, характерное для спиртов (этанол, бутинол, метанол).
Антифриз (от англ. freeze — «замерзать», с приставкой «анти», означающей противоположность) — это не жидкость определенного химического состава, а собирательное понятие, обозначающее любые низкозамерзающие жидкости, применяемые для охлаждения двигателей внутреннего сгорания и различных установок (в том числе систем отопления), работающих при температурах ниже 0°С.
Антифризами так же называют водные растворы некоторых веществ: этиленгликоля, глицерина, неорганических солей и других, не замерзающие при низких температурах (энциклопедический словарь).
В автомобилях в качестве Охлаждающей Жидкости (ОЖ) двигателя используют антифризы, изготовленные на основе водного раствора этиленгликоля с добавлением в него антикоррозионных, антивспенивающих и других присадок. Антифризы различных фирм-производителей отличаются друг от друга составом этих присадок, в редких случаях у антифризов бывает другая основа, например, пропиленгликоль. Цвет жидкости определяется красителем, и он не имеет отношения к другим свойствам антифриза.
Российский ТОСОЛ — это антифриз на основе водного раствора этиленгликоля, большинство российских производителей ОЖ используют его для своей продукции, хотя, как правило, она не имеет никакого отношения к первоначальному ТОСОЛу А-40 или к пришедшему ему на смену ТОСОЛу А-40М (выпускается по ТУ 6-57-48-91).
На автомобильные ОЖ (антифризы, ТОСОЛы) в России действует ГОСТ 28084-89 «Жидкости охлаждающие низкозамерзающие», причем требования этого ГОСТа аналогичны требованиям зарубежных стандартов, например, американского ASTM D3585, а по показателю «Коррозионное воздействие на металлы» эти требования даже более жесткие.
К сожалению, большинство российских ТОСОЛов и Антифризов не соответствует ГОСТу и выпускается производителями по своим ТУ с заниженными требованиями. Для придания «сходства с оригиналом» используются названия типа ТОСОЛ-А40С, ТОСОЛ-А40Д, и т.д..
Отметим, что полное тестирование ОЖ на соответствие ГОСТу является весьма сложной и длительной процедурой и может проводиться лишь в специально оснащенных лабораториях. Однако о качестве продукта можно судить по нижеприведённым параметрам измерение которых проводится достаточно просто при наличии соответствующих приборов.
Плотность при 20°С определяет соотношение гликоля и воды. По ГОСТу плотность должна быть 0,065-1,085 для охлаждающих жидкостей –40°С и 1,085-1,100 для охлаждающих жидкостей –65°С. Если воды будет больше нормы – двигатель попросту замерзнет, если же переборщили с этиленгликолем – ухудшится теплоотдача, двигатель будет перегреваться. Определяется плотность ареометром.
Так, если плотность, измеренная при температуре жидкости 20°С, окажется ниже 1.065, это может означать заниженное содержание этиленгликоля в растворе. ОЖ будет иметь более высокую температуру замерзания, чем положено, причем каждая единица в последнем знаке плотности соответствует 2-3 градусам по температуре. Большой допуск по плотности в ГОСТе (1.065-1.085) задан для ОЖ, изготовленных из других гликолей: пропиленгликоля, диэтиленгликоля и т.д. Несоответствие норме рН и щелочности свидетельствует об отсутствии антикоррозионных присадок, или об их несбалансированном составе.
Температура начала кристаллизации тоже зависит от соотношения вода/гликоль. Началом кристаллизации считается появление облачка мути, видимое невооруженным взглядом. До замерзания антифриза, конечно, еще далеко, но в ГОСТе требования четкие: -40°С для охлаждающей жидкости –40 и -65°С – для охлаждающей жидкости –65.
Водородный показатель (pH) согласно ГОСТу должен быть в пределах 7,5-11,0. Он позволяет судит об агрессивности препарата к металлам и определяется пакетом присадок, в отличие от двух предыдущих параметров, которые зависели от соотношения гликоль/вода. Измеряется pН-метром.
Щелочность. Со временем этиленгликоль может окисляться до уксусной или щавелевой кислоты и поэтому для нейтрализации необходим щелочной буфер (иначе препарат может обретет сильнокислотные свойства и будет разъедать металлы двигателя). ГОСТом декларирован показатель 10. Щелочность определяют потенциометрическим титрованием соляной кислотой.
Кроме того, щелочность обеспечивает стабильность ОЖ в условиях работы при высоких температурах, и заниженное значение щелочности уменьшает срок эксплуатации ОЖ. Водный раствор этиленгликоля, не содержащий присадок, имеет рН=5.5-7.0 и щелочность менее 3.
Фракционные данные – это температура начала перегонки и массовая доля жидкости, перегоняемой до температуры 150°С (в процентах). Это испытание в ГОСТе не является обязательным и производится по требованию. Начало перегонки наступает при 100°С и до достижения 150°С должно отогнаться не более 5/40/50% жидкости (для концентрата, -65 и –40 антифризов). По сути, тест определяет количество воды в составе (напомним, что в концентрате массовая доля воды не должна превышать 5%, в охлаждающей жидкости –65°С рекомендуется соотношение 35% воды и присадок на 65% гликоля, в охлаждающей жидкости –40°С – 47% воды и присадок на 53% гликоля.
Вспениваемость (наличие в ОЖ пеногасителя) можно оценить визуально простым встряхиванием канистры.
Эксплуатация некачественного (не соответствующего ГОСТу) антифриза или ТОСОЛа может привести к неприятным последствиям: «разморозка» двигателя; усиленная коррозия в системе охлаждения; разрушение подшипника насоса охлаждающей жидкости (помпы) при попадании в него твердых частиц продуктов коррозии; появление протечек; плохой теплообмен из-за пенообразования, перегрев двигателя, кипение. Внимание! Экономия при покупке дешевого некачественного антифриза или ТОСОЛа может привести к большим потерям при его использовании.
Купить антифриз — концентрат онлайн
Описание
Почему стоит покупать антифриз — концентрат от ReAgent?
В ReAgent мы поставляем концентрированный антифриз, соответствующий стандарту BS 6580 2010, в контейнерах на 5 и 25 литров, а также в бочках на 200 литров и IBC на 1000 литров. Скидки доступны при оптовых закупках более 4 наименований. Мы также можем предложить другие варианты, включая индивидуальную маркировку или индивидуальное смешивание. Пожалуйста, свяжитесь с нами для получения коммерческого предложения или технических вопросов.
В мире
Антифриз — это продукт, который можно найти в каждом магазине DIY по всему миру! Однако предпочтительный состав сильно варьируется от места к месту, в зависимости от местных потребностей.Основным ингредиентом всегда является пропиленгликоль или этиленгликоль, но остальные ингредиенты, хотя и составляют лишь небольшую часть, могут влиять на характеристики продуктов.
- Антифриз в Европе: Проблемы с жесткой водой привели к разработке продуктов, не содержащих фосфатов. В противном случае элементы, присутствующие в воде, могут реагировать с фосфатом и образовывать коррозионные осадки. Большинство продуктов, доступных по всей Европе, известны как гибриды и вместо них содержат силикаты и карбоксилаты.
- Антифриз в США: Большинство американских продуктов окрашены в зеленый цвет и содержат большое количество фосфатов в своей коррозионной смеси, поскольку вода не представляет того же проблема как в Европе
- Антифриз в Азии: Интересно, что в этом регионе продукты в основном содержат карбоксилаты и фосфаты и избегают силикатов.Они также считаются гибридными продуктами.
- Worldwide antifreeze: Чтобы удовлетворить (практически) все потребности, последние продукты содержат только карбоксилаты. Они не содержат силикатов или фосфатов, поэтому их можно использовать в Европе и Азии, и они становятся очень популярными вариантами. Эти продукты показали очень хорошие результаты во время испытаний, но, к сожалению, их нельзя смешивать с обычными продуктами на фосфатной основе
Более 40 лет опыта
Обладая более чем 40-летним опытом работы в этой области, ReAgent заработал завидную репутацию -качественная продукция и отличное обслуживание клиентов.Мы предлагаем широкий ассортимент антифризов, от нетоксичных до химикатов лабораторного класса. Все наши продукты имеют 100% гарантию качества и обычно отправляются в течение 24 часов.
Файлы MSDS
Следующие файлы доступны для загрузки:
КАК СДЕЛАТЬ АНТИФРИЗ ДЛЯ АВТОМОБИЛЯ | АВТОМОБИЛЬНАЯ ЖИДКОСТЬ | ФОРМУЛА | СТАТЬИ | СОЛЬВЕР ХИМ
- ДОМ
- ЖЕСТКИЕ КНИГИ
- ЭЛЕКТРОННЫЕ КНИГИ
- ЭЛЕКТРОННЫЕ УЧЕБНИКИ
- КЛЕЕВЫЕ ФОРМУЛЯЦИИ ENCYCLOPEDIA TEXT-BOOK / PDF
- ЖИДКОЕ / СОК УДОБРЕНИЯ ЧЕРВИ / húmus líquido /
- ПРОДУКТЫ ПИЩЕВЫХ ПРОДУКТОВ ФОРМУЛЯЦИИ ENCYCLOPEDIA — 2 TEXTBOOKS FEXT ENCOOKOPEDIA — 2 TEXTBOOKS MEX
ENCOKOPEDIA — 2 TEXTBOOKS FEXT ЦВЕТ косметических составов ЭНЦИКЛОПЕДИЯ учебники - ВОЛОСЫ ПРОДУКТЫ СОСТАВОВ ЭНЦИКЛОПЕДИЯ уЧЕБНИКИ
- УХОДА ПРОДУКТЫ СОСТАВОВ ЭНЦИКЛОПЕДИЯ уЧЕБНИКИ
- ТРАВЯНЫХ косметические составы ЭНЦИКЛОПЕДИИ уЧЕБНИКИ
- ПРОМЫШЛЕННЫХ КРАСКИ СОСТАВОВ ЭНЦИКЛОПЕДИИ — 2 уЧЕБНИКОВ
- промышленных краски препаративной ЭНЦИКЛОПЕДИИ — 1 УЧЕБНИКИ
- ПОЛИУРЕТАНОВЫЕ ПОКРЫТИЯ И КРАСКИ ФОРМУЛИРОВКИ ЭНЦИКЛОПЕДИЯ E — УЧЕБНИКИ
- ЭПОКСИДНЫЕ ПОКРЫТИЯ И КРАСКИ ФОРМУЛЯЦИИ ЭПОКСИДНЫЕ ПОКРЫТИЯ И КРАСКИ УЧЕБНИКИ
- КОНСТРУКЦИЯ ХИМИЧЕСКИЕ ФОРМЫ A — 2 E — УЧЕБНИКИ
- СТРОИТЕЛЬНЫЕ ХИМИЧЕСКИЕ ФОРМУЛЯЦИИ ЭНЦИКЛОПЕДИЯ — 1 E — УЧЕБНИКИ
- Аэрозольные аэрозольные составы ENCYCLOPEDIA E — Учебные пособия
- ДЕТЕРГЕНТНЫЕ ПРОДУКТЫ ДИСТАНЦИОННЫЕ ПРОДУКТЫ
- DETERGENT FORMULIES DETERGENT PRODUCTS TEXMULATION РАЗРАБОТКА ПРОДУКТОВ И ПРОЦЕСС ПРОИЗВОДСТВА
- СОСТАВ СМАЗОЧНЫХ МАСЛА E УЧЕБНИКИ
- РЕЦЕПТЫ ПРОДУКТОВ AUTO CARE E — Учебники
- ПИТАТЕЛЬНЫЕ УДОБРЕНИЯ И ЗАЩИТНЫЕ УДОБРЕНИЯ ДЛЯ РАСТЕНИЙ
- УДОБРЕНИЯ И ЗАЩИТА УДОБРЕНИЙ
- ЧЕРТИЛИЗАТОРЫ И СПЕЦИАЛЬНЫЕ УДОБРЕНИЯ
- ФОРМУЛЯЦИИ E — УЧЕБНИКИ
- ЭНЦИКЛОПЕДИЯ ДЛЯ ПРОМЫШЛЕННЫХ ПРОДУКТОВ — 1 Е — УЧЕБНИКИ
- ЭНЦИКЛОПЕДИЯ ДЛЯ ПРОМЫШЛЕННЫХ ПРОДУКТОВ — 2 E — УЧЕБНИКИ
- ГЕРБИЦИДНЫЕ ФОРМУЛЯЦИИ И ПРОДУКЦИЯ АРТИКУЛЫ
- ИНСЕКТИЦИДЫ
- ФУНГИЦИДНЫЕ ФОРМУЛЯЦИИ И ПРИМЕНЕНИЯ СТАТЬИ
- МОЮЩИЕ СРЕДСТВА, ЗАПОЛНЯЮЩИЕ И УПЛОТНИТЕЛЬНЫЕ МАШИНЫ АППАРАТЫ ДЛЯ ПИЩЕВЫХ ПРОДУКТОВ
- ПРОДУКТЫ ДЛЯ ПИЩЕВЫХ ПРОДУКТОВ
- КЛЕИ, ЖЕЛЕЗЫ, КЛЕЙ И ГЕРМЕТИЧЕСКИЕ ИЗДЕЛИЯ
- ПАРФЮМЕРНАЯ И ЦВЕТНАЯ КОСМЕТИКА ИЗДЕЛИЯ
- УХОД ЗА ВОЛОСАМИ ИЗДЕЛИЯ
- УХОД ЗА КОЖЕЙ И УХОД ЗА ВОЛОСАМИ И КОСМЕТИКА
- ИЗДЕЛИЯ ДЛЯ КОСМЕТИКА СЫРЬЯ
- C ИЗДЕЛИЯ ДЛЯ СЫРЬЯ COSMETIC
- Пищевые продукты СОСТАВЫ ЭНЦИКЛОПЕДИЯ ВИДЕО
- парфюмерные и декоративной косметики СОСТАВЫ
- Строительная химия СОСТАВЫ ЭНЦИКЛОПЕДИЯ — 2 ВИДЕО
- Строительная химия СОСТАВЫ ЭНЦИКЛОПЕДИЯ — 1 ВИДЕО
- смазочным маслам СОСТАВЫ ЭНЦИКЛОПЕДИЯ ВИДЕО
- сельскохозяйственных химикатов ЭНЦИКЛОПЕДИЯ ВИДЕО
- аэрозольных спреев ЭНЦИКЛОПЕДИЯ ВИДЕО
- ОРГАНИЧЕСКИХ УДОБРЕНИЙ СОСТАВЫ ЭНЦИКЛОПЕДИЯ ВИДЕО
- ПРОМЫШЛЕННАЯ ДЕТЕРГЕНТ СОСТАВЫ ЭНЦИКЛОПЕДИЯ ВИДЕО
- ДЕТЕРГЕНТ СОСТАВЫ ЭНЦИКЛОПЕДИЯ ВИДЕО
- ДЕЗИНФЕКТАНТ ПРОДУКТЫ СОСТАВЫ ЭНЦИКЛОПЕДИЯ ВИДЕО
- ЭПОКСИДНАЯ ПОКРЫТИЯ И КРАСКИ СОСТАВЫ ЭНЦИКЛОПЕДИЯ ВИДЕО
- ПОЛИУРЕТАНОВЫЕ ПОКРЫТИЯ И СОСТАВ КРАСКИ ЭНЦИКЛОПЕДИЯ ВИДЕО
- ПРОМЫШЛЕННЫЕ КРАСКИ ФОРМУЛЯЦИИ ЭНЦИКЛОПЕДИ A ВИДЕО — 1
- ПРОМЫШЛЕННЫЕ КРАСКИ ФОРМУЛЯЦИИ ЭНЦИКЛОПЕДИЯ ВИДЕО ECLOPEDIA ВИДЕО — 2
- ГЕРБИЦИДНЫЕ ФОРМУЛЯЦИИ БЕЗ ЭНЦИКЛОПЕДИИ ПРИМЕРЫ
- ФУНГИЦИДНЫЕ ФОРМУЛЯЦИИ БЕЗ ЭНЦИКЛОПЕДИИ ПРИМЕР
- ИНСЕКТИЦИДНЫЕ ФОРМУЛЯЦИИ БЕСПЛАТНЫЕ ПРИМЕРЫ ЭНЦИКЛОПЕДИИ
- ПИЩЕВЫЕ ПРОДУКТЫ ФОРМУЛИРОВАНИЯ — ЭНЦИПЕРАТЫ КОСМЕТИЧЕСКИЕ И ЦВЕТОВЫЕ ФОРМУЛЯЦИИ ЭНЦИКЛОПЕДИЯ
- ФОРМУЛЯЦИИ ДЛЯ УХОДА ЗА КОЖЕЙ ПРИМЕРЫ БЕЗ ЭНЦИКЛОПЕДИИ
Антифриз протеин
2
Полимеры спешат на помощь! Спасение клеток от разрушающего льда
Февраль13 февраля 2020 г. — Химики создают основу для разработки эффективных полимеров, которые могут предотвратить рост льда, который повреждает …
Как протеины-антифризы останавливают ледяной холод
9 июля 2018 г. — Существование белков-антифризов (AFP) было известно на протяжении десятилетий, но оказалось, что механизмы, управляющие этим уникальным методом выживания, трудно определить. Новое исследование показывает, как AFP …
Как протеины антифриза заставляют кристаллы льда расти
Мар.7 августа 2019 г. — Бактерии, растения, насекомые и даже рыба используют антифризные белки, чтобы защитить себя от холода. Белки блокируют рост кристаллов льда. В новом исследовании ученые подтвердили, что …
Клеточная ткань не должна замерзать!
6 декабря 2017 г. — Природа разработала сахара, аминокислоты и специальные антифризы в качестве криопротекторов. Люди используют органические растворители и синтетические полимеры в качестве добавок для предотвращения замерзания клеточных культур…
Опрос общепринятых представлений о белках антифризов
1 августа 2018 г. — Ученые обнаружили, что белок, связывающий лед (fcIBP) из микроводорослей морского льда, не соответствует традиционной классификации белков, связывающих лед, что предполагает неизвестные механизмы, лежащие в основе …
Теперь мы знаем, как насекомые и бактерии контролируют лед
12 апреля 2019 г. — Ученые показывают, как ключевые белки, вырабатываемые бактериями и насекомыми, могут либо способствовать, либо препятствовать образованию льда, в зависимости от их длины и их способности объединяться для образования больших ледяных связок…
Nature’s Antifreeze вдохновляет революционную технику криоконсервации бактерий
6 июля 2018 г. — Механизмы выживания полярных рыб привели ученых к разработке революционного подхода к «замораживанию» …
Сперма носорога от холода
11 июля 2018 г. — Новая смесь криопротекторов обеспечивает беспрецедентно высокую подвижность замороженных сперматозоидов носорога после оттаивания, сообщают ученые. Эти новые криозащитные средства могут увеличить перспективы…
Геномное исследование связывает эволюцию насекомых со способностью обнаруживать запахи в воздухе
2 августа 2018 г. — Новое исследование показывает, что все насекомые используют специализированные рецепторы запахов, которые позволяют им обнаруживать и преследовать партнеров, идентифицировать врагов, находить пищу и — к сожалению для людей — распространять болезни. Это …
Ошибка из-за изменения климата
18 апреля 2018 г. — Более теплые летние и осенние сезоны и меньшее количество зимних морозов-оттепелей привели к изменениям относительной численности различных типов насекомых в Арктике.Исследование опирается на самые давние, самые …
Химические формулы
2.2 Химические формулы
Цель обучения
- Для описания химического состава.
Когда химики синтезируют новое соединение, они могут еще не знать его молекулярную или структурную формулу. В таких случаях они обычно начинают с определения его эмпирической формулы Формула для соединения, которая состоит из атомного символа для каждого составляющего элемента, сопровождаемого нижним индексом, указывающим относительное число атомов этого элемента в соединении, уменьшенное до наименьшего целого. числа., относительных чисел атомов элементов в соединении, уменьшенных до наименьших целых чисел. Поскольку эмпирическая формула основана на экспериментальных измерениях количества атомов в образце соединения, она показывает только отношения количества присутствующих элементов. Разницу между эмпирическими формулами и молекулярными можно проиллюстрировать с помощью бутана, ковалентного соединения, используемого в качестве топлива в одноразовых зажигалках. Молекулярная формула бутана: C 4 H 10 .Отношение атомов углерода к атомам водорода в бутане составляет 4:10, которое может быть уменьшено до 2: 5. Таким образом, эмпирическая формула для бутана: C 2 H 5 . Формульная единица Абсолютная группировка атомов или ионов, представленная эмпирической формулой. представляет собой абсолютную группу атомов или ионов, представленную эмпирической формулой соединения, ионного или ковалентного. Бутан, например, имеет эмпирическую формулу C 2 H 5 , но он содержит две формульные единицы C 2 H 5 , что дает молекулярную формулу C 4 H 10 .
Поскольку ионные соединения не содержат дискретных молекул, для обозначения их состава используются эмпирические формулы. Все соединения, ионные или ковалентные, должны быть электрически нейтральными. Следовательно, положительный и отрицательный заряды в формульной единице должны точно компенсировать друг друга. Если катион и анион имеют одинаковые заряды, такие как Na + и Cl —, то соединение должно иметь соотношение катионов к анионам 1: 1, а эмпирическая формула должна быть NaCl.Если заряды различаются по величине, то для получения нейтрального соединения необходимо соотношение катион: анион, отличное от 1: 1. В случае Mg 2+ и Cl —, например, необходимы два иона Cl — для уравновешивания двух положительных зарядов на каждом ионе Mg 2+ , что дает эмпирическую формулу MgCl 2 . Точно так же формула ионного соединения, содержащего ионы Na + и O 2-, — Na 2 O.
Обратите внимание на узор
Ионные соединения не содержат дискретных молекул, поэтому для обозначения их состава используются эмпирические формулы.
Бинарные ионные соединения
Ионное соединение, которое содержит только два элемента, один присутствует в виде катиона, а другой в виде аниона, называется бинарным ионным соединением. Ионное соединение, которое содержит только два элемента, один присутствует в виде катиона, а другой в виде аниона. MgCl 2, коагулянт, используемый при приготовлении тофу из соевых бобов. Для бинарных ионных соединений индексы в эмпирической формуле также могут быть получены путем пересечения зарядов: используйте абсолютное значение заряда на одном ионе в качестве индекса для другого иона.Этот метод схематически показан следующим образом:
Транспортные расходы. Один из методов получения индексов в эмпирической формуле — это пересечение зарядов.
При пересечении сборов иногда бывает необходимо уменьшить индексы до их простейшего отношения, чтобы написать эмпирическую формулу. Рассмотрим, например, соединение, образованное Mg 2+ и O 2-. Использование абсолютных значений зарядов ионов в качестве индексов дает формулу Mg 2 O 2 :
Это упрощает правильную эмпирическую формулу MgO.Эмпирическая формула имеет один ион Mg 2+ и один ион O 2-.
Пример 4
Напишите эмпирическую формулу для простейшего бинарного ионного соединения, образованного из каждого иона или пары элементов.
- Ga 3+ и As 3-
- Eu 3+ и O 2-
- кальций и хлор
Дано: ионов или элементов
Запрошено: эмпирическая формула бинарного ионного соединения
Стратегия:
A Если не указано, определите ионные заряды на основе расположения элементов в периодической таблице.
B Используйте абсолютное значение заряда каждого иона в качестве индекса для другого иона. Уменьшите индексы до наименьших чисел, чтобы написать эмпирическую формулу. Убедитесь, что эмпирическая формула электрически нейтральна.
Решение:
B Использование абсолютных значений зарядов на ионах в качестве индексов дает Ga 3 As 3 :
Уменьшение индексов до наименьших целых чисел дает эмпирическую формулу GaAs, которая электрически нейтральна [+3 + (−3) = 0].В качестве альтернативы мы могли бы признать, что Ga 3+ и As 3- имеют заряды одинаковой величины, но противоположные знаки. Один ион Ga 3+ уравновешивает заряд одного иона As 3-, и соединение 1: 1 не будет иметь чистого заряда. Поскольку мы пишем нижние индексы только в том случае, если число больше 1, эмпирическая формула — GaAs. GaAs — это арсенид галлия, который широко используется в электронной промышленности в транзисторах и других устройствах.
B Поскольку Eu 3+ имеет заряд +3, а O 2- имеет заряд −2, соединение 1: 1 будет иметь чистый заряд +1.Следовательно, мы должны найти кратные списаниям, которые отменяются. Мы перекрестно заряжаем, используя абсолютное значение заряда одного иона в качестве индекса для другого иона:
Нижний индекс для Eu 3+ равен 2 (из O 2-), а нижний индекс для O 2- равен 3 (из Eu 3+ ), что дает Eu 2 O 3 ; нижние индексы нельзя уменьшить. Эмпирическая формула содержит положительный заряд 2 (+3) = +6 и отрицательный заряд 3 (−2) = −6 для чистого заряда 0.Соединение Eu 2 O 3 нейтрально. Оксид европия отвечает за красный цвет экранов телевизоров и компьютеров.
A Поскольку заряды на ионах не указаны, мы должны сначала определить ожидаемые заряды для наиболее распространенных ионов, полученных из кальция и хлора. Кальций находится в группе 2, поэтому он должен потерять два электрона, чтобы сформировать Ca 2+ . Хлор находится в группе 17, поэтому он должен получить один электрон, чтобы образовать Cl — .
B Два иона Cl — необходимы для уравновешивания заряда на одном ионе Ca 2+ , что приводит к эмпирической формуле CaCl 2 . Мы также могли бы перекрестно заряжать, используя абсолютное значение заряда для Ca 2+ в качестве нижнего индекса для Cl и абсолютное значение заряда для Cl — в качестве нижнего индекса для Ca:
.Нижние индексы в CaCl 2 не подлежат дальнейшему уменьшению.Эмпирическая формула электрически нейтральна [+2 + 2 (−1) = 0]. Это соединение хлорид кальция, одно из веществ, используемых в качестве «соли» для таяния льда на дорогах и тротуарах зимой.
Упражнение
Напишите эмпирическую формулу для простейшего бинарного ионного соединения, образованного из каждого иона или пары элементов.
- Li + и N 3-
- Al 3+ и O 2-
- литий и кислород
Ответ:
- Li 3 N
- Al 2 O 3
- Li 2 O
Многоатомные ионы
Многоатомные ионы Группа из двух или более атомов, обладающая чистым электрическим зарядом.представляют собой группы атомов, которые несут общий электрический заряд, хотя атомы в многоатомном ионе удерживаются вместе теми же ковалентными связями, которые удерживают атомы вместе в молекулах. Подобно тому, как существует намного больше видов молекул, чем простых элементов, существует гораздо больше видов многоатомных ионов, чем одноатомных ионов. Двумя примерами многоатомных катионов являются ионы аммония (NH 4 + ) и метиламмония (CH 3 NH 3 + ). Многоатомных анионов гораздо больше, чем многоатомных катионов; некоторые общие примеры приведены в таблице 2.4 «Общие многоатомные ионы и их названия».
Таблица 2.4 Общие многоатомные ионы и их названия
| Формула | Имя Иона |
|---|---|
| NH 4 + | аммоний |
| CH 3 NH 3 + | метиламмоний |
| ОН — | гидроксид |
| O 2 2- | перекись |
| CN — | цианид |
| SCN — | тиоцианат |
| НЕТ 2 — | нитрит |
| НЕТ 3 — | нитрат |
| CO 3 2- | карбонат |
| HCO 3 — | гидрокарбонат или бикарбонат |
| SO 3 2- | сульфит |
| SO 4 2- | сульфат |
| HSO 4 — | гидросульфат или бисульфат |
| PO 4 3- | фосфат |
| HPO 4 2- | гидрофосфат |
| H 2 PO 4 — | дигидрофосфат |
| ClO — | гипохлорит |
| ClO 2 — | хлорит |
| ClO 3 — | хлорат |
| ClO 4 — | перхлорат |
| MnO 4 — | перманганат |
| CrO 4 2- | хромат |
| Cr 2 O 7 2- | дихромат |
| C 2 O 4 2- | оксалат |
| HCO 2 — | формиат |
| CH 3 CO 2 — | ацетат |
| C 6 H 5 CO 2 — | бензоат |
Метод, который мы использовали для предсказания эмпирических формул для ионных соединений, содержащих одноатомные ионы, можно также использовать для соединений, содержащих многоатомные ионы.Общий заряд катионов должен уравновешивать общий заряд анионов в формульной единице. Таким образом, ионы K + и NO 3 — объединяются в соотношении 1: 1 с образованием KNO 3 (нитрата калия или селитры), основного ингредиента черного пороха. Точно так же Ca 2+ и SO 4 2- образуют CaSO 4 (сульфат кальция), который соединяется с различными количествами воды с образованием гипса и штукатурки Парижа. Многоатомные ионы NH 4 + и NO 3 — образуют NH 4 NO 3 (нитрат аммония), который является широко используемым удобрением и, в чужих руках, взрывчатым веществом.Одним из примеров соединения, в котором ионы имеют заряды разной величины, является фосфат кальция, который состоит из ионов Ca 2+ и PO 4 3- ; это основной компонент костей. Соединение электрически нейтрально, потому что ионы объединяются в соотношении три иона Ca 2+ [3 (+2) = +6] на каждые два иона [2 (−3) = −6], что дает эмпирическую формулу Ca 3 (PO 4 ) 2 ; круглые скобки вокруг PO 4 в эмпирической формуле указывают на то, что это многоатомный ион.Запись формулы фосфата кальция в виде Ca 3 P 2 O 8 дает правильное количество каждого атома в формульной единице, но затушевывает тот факт, что соединение содержит легко идентифицируемый PO 4 3- ионы.
Пример 5
Напишите эмпирическую формулу соединения, образованного каждой ионной парой.
- Na + и HPO 4 2-
- Катион калия и анион цианида
- Катион кальция и анион гипохлорита
Дано: ионов
Запрошено: эмпирическая формула для ионного соединения
Стратегия:
A Если не указан, определите заряд одноатомного иона по его положению в периодической таблице.Используйте Таблицу 2.4 «Общие многоатомные ионы и их названия», чтобы найти заряд многоатомного иона.
B Используйте абсолютное значение заряда каждого иона в качестве индекса для другого иона. При написании эмпирической формулы сократите индексы до наименьших целых чисел.
Решение:
- B Поскольку HPO 4 2- имеет заряд -2, а Na + имеет заряд +1, эмпирическая формула требует, чтобы два иона Na + уравновесили заряд многоатомного иона, давая Na 2 HPO 4 .Нижние индексы сокращаются до наименьших чисел, поэтому эмпирическая формула: Na 2 HPO 4 . Это соединение представляет собой гидрофосфат натрия, который используется для придания текстуры плавленому сыру, пудингам и быстрым завтракам.
- A Катион калия — K + , а анион цианида — CN —. B Поскольку величина заряда на каждом ионе одинакова, эмпирическая формула — KCN. Цианистый калий очень токсичен, и одно время его использовали как крысиный яд.Однако это использование было прекращено, поскольку слишком много людей были случайно отравлены.
- A Катион кальция — Ca 2+ , а анион гипохлорита — ClO —. B Два иона ClO — необходимы для уравновешивания заряда на одном ионе Ca 2+ , что дает Ca (ClO) 2 . Нижние индексы не могут быть далее уменьшены, поэтому эмпирическая формула Ca (ClO) 2 . Это гипохлорит кальция, «хлор», используемый для очистки воды в плавательных бассейнах.
Упражнение
Напишите эмпирическую формулу соединения, образованного каждой ионной парой.
- Ca 2+ и H 2 PO 4 —
- Катион натрия и анион бикарбоната
- Катион аммония и сульфат-анион
Ответ:
- Ca (H 2 PO 4 ) 2 : дигидрофосфат кальция является одним из ингредиентов разрыхлителя.
- NaHCO 3 : бикарбонат натрия содержится в антацидах и разрыхлителе; в чистом виде продается как пищевая сода.
- (NH 4 ) 2 SO 4 : сульфат аммония является обычным источником азота в удобрениях.
Гидраты
Многие ионные соединения встречаются в виде гидратов — соединений, которые содержат определенные соотношения слабосвязанных молекул воды, называемые водами гидратации., соединения, которые содержат определенные соотношения слабосвязанных молекул воды, называемые водами гидратации — это слабосвязанные молекулы воды в гидратных соединениях. Эти гидратационные воды часто можно удалить, просто нагревая смесь. Гидратационные воды часто можно удалить простым нагреванием. Например, дигидрофосфат кальция может образовывать твердое вещество, которое содержит одну молекулу воды на единицу Ca (H 2 PO 4 ) 2 единиц и используется в качестве разрыхлителя в пищевой промышленности для повышения уровня выпечки.Эмпирическая формула для твердого вещества: Ca (H 2 PO 4 ) 2 · H 2 O. Напротив, сульфат меди обычно образует голубое твердое вещество, которое содержит пять гидратных вод на формульную единицу, с эмпирической формулой CuSO 4 · 5H 2 O. При нагревании все пять молекул воды теряются, давая белое твердое вещество с эмпирической формулой CuSO 4 (Рисунок 2.9 «Потеря воды из гидрата при нагревании») ).
Рисунок 2.9 Потеря воды из гидрата при нагревании
При нагревании синего CuSO 4 · 5H 2 O две молекулы воды теряются при 30 ° C, еще две при 110 ° C и последняя при 250 ° C с образованием белого CuSO 4 .
Соединения, которые различаются только количеством гидратных вод, могут иметь самые разные свойства. Например, CaSO 4 · ½H 2 O — гипс из Парижа, который часто использовался для изготовления прочных слепков для сломанных рук или ног, тогда как CaSO 4 · 2H 2 O — менее плотный, более хлопьевидный гипс. , минерал, используемый в панелях гипсокартона для жилищного строительства.После схватывания гипса смесь гипса и воды кристаллизовалась, давая твердый CaSO 4 · 2H 2 O. Подобные процессы используются при схватывании цемента и бетона.
Сводка
Эмпирическая формула дает относительных чисел атомов элементов в соединении, уменьшенных до наименьших целых чисел. Формульная единица представляет собой группу абсолютного , представленную эмпирической формулой соединения, ионного или ковалентного.Эмпирические формулы особенно полезны для описания состава ионных соединений, которые не содержат легко идентифицируемых молекул. Некоторые ионные соединения встречаются в виде гидратов , которые содержат определенные соотношения слабосвязанных молекул воды, называемых гидратными водами .
Ключевой вынос
- Состав соединения представлен эмпирической или молекулярной формулой, каждая из которых состоит по крайней мере из одной формульной единицы.
Концептуальные проблемы
Каковы различия и сходства между многоатомным ионом и молекулой?
Классифицируйте каждое соединение как ионное или ковалентное.
- Zn 3 (PO 4 ) 2
- C 6 H 5 CO 2 H
- K 2 Cr 2 O 7
- СН 3 СН 2 СН
- NH 4 Br
- CCl 2 F 2
Классифицируйте каждое соединение как ионное или ковалентное.Какие органические соединения и какие неорганические соединения?
- CH 3 CH 2 CO 2 H
- CaCl 2
- Y (НЕТ 3 ) 3
- H 2 S
- NaC 2 H 3 O 2
Как правило, невозможно определить молекулярную формулу непосредственно из эмпирической формулы.Какая еще информация нужна?
Приведите две части информации, которую мы получаем из структурной формулы, которую мы не можем получить из эмпирической формулы.
Формулы спиртов часто записываются как ROH, а не как эмпирические формулы. Например, метанол обычно записывается как CH 3 OH, а не как CH 4 O.Объясните, почему предпочтительнее обозначение ROH.
Соединение диметилсульфида имеет эмпирическую формулу C 2 H 6 S и структурную формулу CH 3 SCH 3 . Какую информацию мы получаем из структурной формулы, чего не получаем из эмпирической формулы? Напишите сокращенную структурную формулу соединения.
Какова правильная формула гидроксида магния — MgOH 2 или Mg (OH) 2 ? Зачем?
Цианид магния обозначается как Mg (CN) 2 , а не MgCN 2 .Зачем?
Всегда ли данный гидрат содержит одинаковое количество гидратных вод?
Ответ
Структурная формула дает нам возможность соединения атомов в молекуле или ионе, а также схематическое представление их расположения в пространстве.Эмпирические формулы говорят нам только отношения присутствующих атомов. Конденсированная структурная формула диметилсульфида: (CH 3 ) 2 S.
Числовые задачи
Напишите формулы для каждого соединения.
- сульфат магния, содержащий 1 атом магния, 4 атома кислорода и 1 атом серы
- этиленгликоль (антифриз), содержащий 6 атомов водорода, 2 атома углерода и 2 атома кислорода
- уксусная кислота, содержащая 2 атома кислорода, 2 атома углерода и 4 атома водорода
- хлорат калия, содержащий 1 атом хлора, 1 атом калия и 3 атома кислорода
- Пентагидрат гипохлорита натрия, содержащий 1 атом хлора, 1 атом натрия, 6 атомов кислорода и 10 атомов водорода
Напишите формулы для каждого соединения.
- ацетат кадмия, содержащий 1 атом кадмия, 4 атома кислорода, 4 атома углерода и 6 атомов водорода
- Цианид бария, содержащий 1 атом бария, 2 атома углерода и 2 атома азота
- дигидрат фосфата железа (III), содержащий 1 атом железа, 1 атом фосфора, 6 атомов кислорода и 4 атома водорода
- гексагидрат нитрата марганца (II), содержащий 1 атом марганца, 12 атомов водорода, 12 атомов кислорода и 2 атома азота
- Фосфат серебра, содержащий 1 атом фосфора, 3 атома серебра и 4 атома кислорода
Заполните следующую таблицу, заполнив формулу ионного соединения, образованного каждой парой катион-анион.
Ион К + Fe 3+ NH 4 + Ba 2+ Класс — KCl SO 4 2- PO 4 3- НЕТ 3 — ОН — Напишите эмпирическую формулу бинарного соединения, образованного наиболее распространенными одноатомными ионами, образованными каждой парой элементов.
- цинк и сера
- барий и йод
- магний и хлор
- кремний и кислород
- натрий и сера
Напишите эмпирическую формулу бинарного соединения, образованного наиболее распространенными одноатомными ионами, образованными каждой парой элементов.
- литий и азот
- цезий и хлор
- германий и кислород
- рубидий и сера
- мышьяк и натрий
Напишите эмпирическую формулу для каждого соединения.
- Na 2 S 2 O 4
- B 2 H 6
- C 6 H 12 O 6
- П 4 О 10
- КМнО 4
Напишите эмпирическую формулу для каждого соединения.
- Al 2 Класс 6
- K 2 Cr 2 O 7
- C 2 H 4
- (NH 2 ) 2 CNH
- CH 3 COOH
ответов
- MgSO 4
- C 2 H 6 O 2
- C 2 H 4 O 2
- KClO 3
- NaOCl · 5H 2 O
Ион К + Fe 3+ NH 4 + Ba 2+ Класс – KCl FeCl 3 NH 4 Класс BaCl 2 SO 4 2− К 2 SO 4 Fe 2 (SO 4 ) 3 (NH 4 ) 2 SO 4 BaSO 4 PO 4 3− К 3 PO 4 FePO 4 (NH 4 ) 3 PO 4 Ba 3 (PO 4 ) 2 НЕТ 3 – КНО 3 Fe (НЕТ 3 ) 3 NH 4 NO 3 Ba (НЕТ 3 ) 2 OH – КОН Fe (OH) 3 NH 4 OH Ba (OH) 2 - Li 3 N
- CsCl
- GeO 2
- руб. 2 руб.
- Na 3 As
- AlCl 3
- K 2 Cr 2 O 7
- СН 2
- CH 5 N 3
- СН 2 О

